Nghiên cứu chế tạo và xác định đặc tính màng trên cơ sở chitosan và tinh bột
MỞ ĐẦU
Cùng với sự phát triển của khoa học kỹ thuật, ngành công nghệ chế biến thủy sản cũng phát triển vượt bậc và đóng góp một phần không nhỏ vào việc phát triển nền kinh tế đất nước. Tuy nhiên, công nghệ chế biến thủy sản phát triển bên cạnh những thuận lợi như chế biến ra các mặt hàng thủy sản có chất lượng cao phục vụ cho xuất khẩu và tiêu thụ trong nước còn có bất lợi là lượng phế liệu thủy sản thải ra rất nhiều làm ô nhiễm môi trường. Một trong những nguồn phế liệu thải ra là vỏ của các động vật giáp xác như tôm, cua, ghẹ… Nguồn phế liệu này hiện nay chủ yếu dùng làm thức ăn chăn nuôi hay làm phân bón nên hiệu quả kinh tế rất thấp. Mục tiêu đặt ra cho các nhà công nghệ là nghiên cứu để tận dụng tối đa những thành phần có trong phế liệu thủy sản nhằm nâng cao hiệu quả kinh tế của chúng và tránh được ô nhiễm môi trường do chúng gây nên.
Trong các mặt hàng thủy sản có giá trị kinh tế thì các mặt hàng thủy sản đông lạnh từ giáp xác chiếm từ 70 – 80% công suất chế biến. Vì vậy, lượng phế liệu từ vỏ giáp xác do các nhà máy thủy sản thải ra khá lớn khoảng 70.000 tấn/năm [1]. Nguồn phế liệu này chứa một lượng lớn chitin, đây là nguồn nguyên liệu quan trọng cho công nghiệp sản xuất chitosan.
Trên thực tế, chitin là biopolymer phổ biến thứ hai sau cellulose. Cũng giống như cellulose, chitin tuy rất phổ biến trong tự nhiên nhưng lại khó ứng dụng trực tiếp do khả năng hòa tan kém, nhiệt độ nóng chảy cao hơn nhiệt độ phân hủy. Chính vì vậy người ta phải biến tính và cắt ngắn mạch phân tử của chitin thì mới có thể ứng dụng được. Sản phẩm phổ biến được sản xuất trực tiếp từ chitin là chitosan. Chitosan có khả năng hòa tan trong dung dịch acid loãng nên thuận tiện cho việc gia công các sản phẩm dạng màng. Màng chitosan có độ bền cơ học cao, ít thấm ẩm. Chitosan có rất nhiều đặc tính tốt như không độc, tương thích sinh học, phân hủy sinh học và đặc biệt là khả năng kháng khuẩn. Vì vậy nó được ứng dụng nhiều trong lĩnh vực y tế, thực phẩm, mỹ phẩm.
Chitosan là một hợp chất sinh học có tính ưu việt rất phù hợp cho việc bảo quản thực phẩm, rau quả. Ngoài khả năng kháng vi sinh vật, chitosan còn có khả năng hạn chế quá trình hô hấp hiếu khí tự nhiên của rau quả vì vậy trái cây sẽ được bảo quản lâu hơn [2]. Mặt dù màng chitosan có rất nhiều ưu điểm trong bảo quản một số loại rau quả sau thu hoạch nhưng nó cũng có những hạn chế, ví dụ khả năng ức chế một số loại vi sinh vật kém, khó điều chỉnh độ thấm CO2 và O2 [3].
Vì vậy để ứng dụng một cách có hiệu quả màng chitosan, người ta thường kết hợp nó với các thành phần khác.
Tinh bột là một nguồn polymer sinh học dồi dào, rẻ tiền, an toàn và phân hủy sinh học. Tinh bột cũng được sử dụng rất nhiều để tổng hợp vật liệu phân hủy sinh học thay thế cho polymer tổng hợp do chi phí thấp và khả năng phân hủy sinh học. Tuy nhiên, vật liệu đi từ tinh bột chưa được ứng dụng nhiều bởi màng tinh bột yếu về mặt cơ học, không bền khi gặp môi trường nước, dễ bị vi khuẩn, nấm tấn công nên khả năng ứng dụng để làm màng bảo quản thấp. Để tăng cường khả năng chịu nước và tính chất cơ học cho màng tinh bột người ta đã tiến hành tạo liên kết ngang. Tuy nhiên mức độ cải thiện hai tính chất cũng chưa đạt như mong đợi [4]. Từ những phân tích trên cho thấy nếu kết hợp tinh bột và chitosan thì sẽ có thể kết hợp được các ưu điểm và hạn chế nhược điểm của những loại polymer thành phần. Ngoài ra còn có thể điều chỉnh khả năng thấm ẩm, thấm khí, độ bền cơ lí của màng một cách dễ dàng. Đề tài “Nghiên cứu chế tạo và xác định đặc tính màng trên cơ sở chitosan và tinh bột” được đề xuất nhằm thực hiện mục đích này. Mục tiêu trước mắt của đề tài là tạo ra được màng trên cơ sở phối hợp giữa chitosan và tinh bột và xác định một số đặc tính của màng chế tạo được.
CHƯƠNG 1 – TỔNG QUAN
1.1. Tổng quan về chitin – chitosan:
Trong tự nhiên chitin tồn tại ở động vật và thực vật và là thành phần chính trong bộ xương ngoài của động vật giáp xác như tôm, cua hay mực [5].
Chitin – chitosan có khối lượng phân tử lớn. Cấu trúc của chitin là tổ hợp các monosaccharide liên kết với nhau bằng các liên kết glycozit và hình thành các sợi có tổ chức. Hơn nữa, chitin rất hiếm khi tồn tại ở trạng thái tự do và hầu như luôn luôn liên kết với các hợp chất như protein, CaCO3 và các hợp chất hữu cơ khác [6].
1.1.1 Cấu trúc phân tử của chitin và chitosan:
1.1.2. Các loại nguyên vật liệu sản xuất chitin
Chitin và chitosan có thể được chiết rút từ nhiều nguồn nguyên liệu như từ vỏ tôm cua, tảo, nấm, vi khuẩn và sâu bọ. Nguồn phế thải tôm, cua, ghẹ, nang mực trong quá trình chế biến thủy sản là nguồn nguyên liệu sẵn có, nhiều, chứa hàm lượng chitin cao.
1.1.3. Tính chất của chitosan:
Chitosan là chất rắn, xốp, nhẹ, không mùi, không vị, ở dạng bột có màu trắng ngà, dạng vẩy có màu trắng trong hay hơi vàng.
Chitosan có tính kiềm nhẹ, không hoà tan trong nước và trong kiềm nhưng hoà tan dễ dàng trong các dung dịch axit loãng như axit acetic, axit propionic, axit lactic, axit citric …. Khi hoà tan chitosan trong môi trường axit loãng tạo thành keo dương. Đây là một điểm rất đặc biệt vì phần lớn các keo polyssacharide có điện tích âm. Chitosan được xem như là một polycation có khả năng bám dính vào bề mặt các điện tích âm và có khả năng tạo phức với một số ion kim loại.
Chitosan khi hoà tan trong dung dịch axit acetic loãng có pH = 6 – 6.5 tạo thành một dung dịch keo dương, nhờ đó mà keo Chitosan không bị kết tủa khi có mặt của một số ion kim loại nặng như Pb3+, Hg2+.
Trong các biến tính hóa học của chitosan nhóm chức amino có thể xảy ra các phản ứng hóa học như phản ứng acetyl hóa, phản ứng tạo base bậc 4, phản ứng với các aldehyde và cetone hình thành nên các base Schiff… từ đó tạo ra các hợp chất khác nhau có những đặc tính ưu việt hơn như kháng vi khuẩn, kháng nấm, kháng oxy hóa, kháng virus, kháng acid, kháng ung bướu, không độc, không dị ứng, hoàn toàn có tính tương hợp sinh học và tự hủy sinh học. Còn ở vị trí nhóm hydroxyl cũng có thể xảy ra một vài phản ứng hóa học như phản ứng o-acetyl hóa, liên kết hydro với nguyên tử phân cực, phản ứng ghép…Do chitin có khả năng phản ứng và tính hòa tan kém nên chitosan đã thu hút được nhiều nhà nghiên cứu để tạo các dẫn xuất có cấu trúc được rõ ràng với những tính chất và chức năng tốt hơn [12].
Chitosan có tính tương thích sinh học cao, không độc hại và biểu hiện các đặc tính bảo quản. Nó được áp dụng rộng rãi trong nhiều lĩnh vực, bao gồm chăm sóc y tế, điều trị kháng khuẩn, quản lý nước thải, ổn định enzyme và mỹ phẩm. Tuy nhiên, do tính hòa tan của nó, chitosan rất khó xử lý, dẫn đến chức năng và khả năng ứng dụng bị hạn chế mặc dù chitosan thể hiện các hoạt động sinh học có giá trị khác nhau, chẳng hạn như hoạt động chống ung thư, hoạt động miễn dịch, hoạt động hạ đường huyết, hoạt động diệt khuẩn của chitosan đặc biệt thú vị. Hoạt động kháng khuẩn của các dẫn xuất chitosan có hiệu quả trong việc ức chế sự phát triển của tế bào vi khuẩn (hoạt tính kháng khuẩn bị ảnh hưởng bởi trọng lượng phân tử, mức độ deacetyl, nồng độ trong dung dịch và pH của môi trường). Ức chế hoạt động kháng khuẩn bằng chitosan biến tính cụ thể là ức chế kháng khuẩn của E. coli, C. albicans, S. aureus và M. furfur có thể đạt tới 95% sau khi sử dụng chitosan nồng độ thấp (1 mg/mL). Ở nồng độ 5 mg/L và 10 mg/mL, khả năng ức chế kháng khuẩn đạt 70-100% so với hầu hết các loài vi khuẩn, ngoại trừ P. aeruginosa. Ngược lại, khả năng ức chế không hiệu quả đối với P. aeruginosa đã được phát hiện ở nồng độ chitosan kiềm hóa 5 mg/mL, trong khi đó, tỷ lệ khả năng ức chế cao 91,2% vẫn đạt được ở nồng độ chitosan 10 mg/mL. Chitosan kiềm hóa cũng có hiệu quả chống lại vi khuẩn kỵ khí như P. mụn trứng cá, với tỷ lệ khả năng ức chế cao 95% được quan sát thấy ở nồng độ 10 mg/mL. Hoạt động kháng khuẩn của các dẫn xuất chitosan được phát hiện rõ nhất ở vi khuẩn gram âm và nhiễm khuẩn [13].
Chitosan kết hợp với aldehyde trong điều kiện thích hợp để hình thành gel, đây là cơ sở để bẫy tế bào, enzym.
Tính chất của chitosan phụ thuộc rất nhiều vào độ tinh khiết, độ deacetyl hóa, phân tử lượng. Chitosan có độ tinh khiết càng cao thì càng dễ tan, dung dịch hòa tan có độ trong cao, có tính kết dính cao và được ứng dụng vào nhiều lĩnh vực hơn. Độ deacetyl hóa là một thông số quan trọng, đặc trưng cho tỉ lệ giữa 2-acetamido-2-deoxy-D-glucopyranose với 2-amino-2-deoxy-D-glucopyranose trong phân tử chitosan. Khả năng thấm nước của màng chitosan có độ deacetyl hóa thấp thì sẽ cao hơn so với màng chitosan có độ deacetyl hóa cao [14].
Phân tử lượng của chitosan cũng là một thông số quan trọng [15], nó quyết định tính chất của chitosan như khả năng kết dính, tạo màng, tạo gel, khả năng hấp phụ chất màu [16].
Chitosan có nhiều tác dụng sinh học đa dạng như khả năng hút nước, giữ ẩm, kháng nấm, kháng khuẩn với nhiều chủng loại khác nhau [17]-[20]. Kích thích tăng sinh tế bào ở người và động thực vật, có khả năng nuôi dưỡng tế bào trong điều kiện nghèo dinh dưỡng.
1.1.4. Ứng dụng của chitosan
Chitosan và dẫn xuất của chúng có rất nhiều ứng dụng trong nông nghiệp, công nghiệp thực phẩm, công nghiệp nhẹ, y học và một số ngành khác. Chitosan có thể được bào chế ra nhiều hình thức khác nhau: chất dẻo, bột nhuyễn, lát mỏng, hoặc hơi xịt…
Trong y học: Từ chitosan của vỏ cua, tôm có thể sản xuất glucosamin, một dược chất quý dùng để chữa khớp. Chúng thường được dùng làm các tác nhân hạ cholesterol, vật liệu vá vết thương, vật liệu chữa bỏng, vật liệu y sinh học và dược phẩm, chất chống đông máu, chống ung thư và làm kính áp tròng.
Trong công nghiệp: Chitosan được dùng trong nhiếp ảnh, trong ngành giấy và trong xử lý dệt nhuộm và in.
Trong nông nghiệp: Chitosan được dùng làm phân bón kích thích sinh trưởng cây trồng.
Trong công nghệ thực phẩm: Làm bao bì bảo quản thực phẩm, kháng khuẩn. Chitosan có nguồn gốc tự nhiên, không độc và rất an toàn cho người khi sử dụng làm thực phẩm [21]. Tạo lớp màng bên ngoài nhằm hạn chế sự phát triển vi sinh vật bề mặt, một nguyên nhân chính gây thối hỏng thực phẩm, thay thế cho bao bì PE. Màng chitosan dễ phân hủy trong môi trường tự nhiên.

1.2. Tổng quan về tinh bột sắn:
1.2.1. Giới thiệu tinh bột
Tinh bột là một phân tử polysacarit tự nhiên, phân hủy sinh học, rẻ tiền, có thể tái tạo và có sẵn. Các nguồn tinh bột thực vật khác nhau là ngũ cốc (lúa mì, ngô, gạo, lúa mạch, yến mạch, lúa miến, kê và lúa mạch đen), cây họ đậu (đậu lăng, đậu đỏ, đậu xanh, đậu tương, lạc…), một số cây họ đậu chưa được sử dụng (đậu kiếm, đậu bồ câu), rễ và củ (sắn, khoai tây, khoai mỡ, khoai lang) và trái cây chưa chín (chuối, xoài). Hạt tinh bột chủ yếu được tìm thấy trong hạt, rễ và củ, cũng như trong thân, lá, quả và thậm chí là phấn hoa [22].
Tinh bột có khối lượng phân tử cao gồm các đơn vị glucose được nối với nhau bởi các liên kết α-glycozide, có công thức phân tử là (C6H10O5)n, ở đây n có thể từ vài trăm đến vài ngàn. Trong thực vật, tinh bột thường ở dạng không hoà tan trong nước. Do đó có thể tích tụ một lượng lớn ở trong tế bào mà vẫn không ảnh hưởng đến áp suất thẩm thấu. Tinh bột không phải là một chất riêng biệt, nó bao gồm hai thành phần là amylose và amylopectin. Amylose là polymer mạch thẳng, chứa từ từ 500-2.000 đơn vị glucose, liên kết nhau bởi liên kết α-1,4 glycozide. Amylopectin là polyme mạch nhánh, ngoài mạch chính có liên kết α-1,4 glycozide còn có nhánh liên kết với mạch chính bằng liên kết α-1,6 glycozide. Cấu trúc nhánh này làm cho phân tử cồng kềnh hơn, chiều dài của mạch nhánh này khoảng 25-30 đơn vị glucose. Phân tử amylopectin có thể chứa tới 100.000 đơn vị glucose. Hai chất này khác nhau nhiều về tính chất lý học, hóa học và chúng qui định nên tính chất lý hóa của tinh bột.
Tinh bột được biến hình để giúp ngăn cản những thay đổi không mong muốn về cấu trúc, cảm quan cũng như sự thoái hóa hoặc phân hủy tinh bột trong quá trình chế biến và lưu trữ. Các tính chất “sẵn có” của tinh bột có thể thay đổi nếu chúng bị biến hình để thu được những tính chất mới, thậm chí hoàn toàn mới lạ. Việc thay đổi các tính chất có thể thực hiện bằng các phản ứng hóa học khác nhau như thủy phân, oxy hóa, ether hóa, ester hóa, liên kết ngang.
Liên kết ngang là một cách tiếp cận phổ biến để cải thiện hiệu quả của tinh bột cho các ứng dụng khác nhau. Tinh bột và các sản phẩm tinh bột đã được liên kết ngang với các tác nhân liên kết ngang, chẳng hạn như phosphorus oxychloride, sodium trimetaphosphate, so- dium tripolyphosphate, epichlorohydrin, and 1,2,3,4-diepoxy- butane để cải thiện các tính chất cơ học và sự ổn định của nước đối với sản phẩm tinh bột.
1.2.2. Hình dạng, đặc điểm, kích thước hạt tinh bột
Các cacbonhydrat đầu tiên được tạo ra ở diệp lục do quang hợp, nhanh chóng được chuyển thành tinh bột. Tinh bột ở mức độ này được gọi là tinh bột đồng hóa, rất linh động, có thể được sử dụng ngay trong quá trình trao đổi chất hoặc có thể được chuyển hóa thành tinh bột dự trữ ở trong hạt, quả, củ, rễ, thân và bẹ lá [24].
Tinh bột sắn có dạng hình cầu, hình trứng hoặc hình mũ, có một số hạt trũng, điều này có thể nhận thấy từ kết quả chụp hiển vi điện tử quét [26], [27].
Kích thước hạt tinh bột qua phương pháp nhiễu xạ tia X:
Kính hiển vi điện tử quét có thể xác định kích thước trung bình của hạt tinh bột nhưng chỉ những hạt nằm trong vùng quan sát của kính, nên số liệu không đặc trưng cho toàn khối hạt.
Những phương pháp khác như phương pháp lắng, hoặc rây, sàng để phân chia hệ thống tinh bột ra các phần có kích thước đồng đều rồi nghiên cứu thì mất thời gian, không chính xác (hạt to lẫn hạt nhỏ).
Để khắc phục điều này, ta có thể sử dụng phương pháp nhiễu xạ tia X. Nó có thể phân tích và xử lý số liệu đo được một cách nhanh chóng và chính xác [28].
Cấu tạo và kích thước của hạt tinh bột phụ thuộc vào giống cây, điều kiện trồng trọt cũng như quá trình sinh trưởng của cây.
Cấu tạo bên trong của vi hạt khá phức tạp. Vi hạt tinh bột có cấu tạo lớp, trong mỗi lớp đều có lẫn lộn các amylose dạng tinh thể và amylopectin sắp xếp theo phương hướng tâm.
Nhờ phương pháp hiển vi điện tử quét và nhiễu xạ tia X thấy rằng trong hạt tinh bột “nguyên thủy” có chuỗi polysaccait của amylose và amylopectin tạo thành xoắn ốc với ba gốc glucose một vòng. Trong tinh bột của các hạt ngũ cốc, các phân tử có chiều dài từ 0,35 – 0,7µm; trong khi đó chiều dày của một lớp hạt tinh bột là 0,1 µm. Hơn nữa, các phân tử lại sắp xếp theo hướng tâm nên các mạch glucoside của các polysaccarit phải ở dạng gấp khúc nhiều lần.
Các mạch polysaccarit sắp xếp hướng tâm tạo ra độ tinh thể: các mạch nhánh của một phân tử amylopectin này nằm xen kẽ giữa các mạch nhánh của phân tử kia. Ngoài cách sắp xếp bên trong như vậy, mỗi hạt tinh bột còn có vỏ bọc phía ngoài. Đa số các nhà nghiên cứu [25] cho rằng vỏ hạt tinh bột khác với tinh bột bên trong, chứa ít ẩm hơn và bền đối với các tác động bên ngoài. Trong hạt tinh bột có lỗ xốp nhưng không đều. Vỏ hạt tinh bột cũng có lỗ nhỏ do đó các chất hòa tan có thể xâm nhập vào bên trong bằng con đường khuếch tán.
1.2.3. Thành phần hóa học của tinh bột [26], [27], [29].
Tinh bột không phải một hợp chất đồng thể mà gồm hai polysaccarit khác nhau: amylose và amylopectin. Tỉ lệ amylose/amylopectin xấp xỉ 1/4.
Trong tinh bột nếp (gạo nếp hoặc ngô nếp) gần như 100% là amylopectin. Trong tinh bột đậu xanh, dong riềng hàm lượng amylose chiếm trên 50%.
1.2.4. Thành phần, cấu trúc của amylose [26], [27].
Amylose là loại mạch thẳng, chuỗi dài từ 500-2000 đơn vị glucose, liên kết nhau bởi liên kết α – 1,4 glicozit. Amylose “nguyên thủy” có mức độ trùng hợp không phải hàng trăm mà là hàng ngàn.
1.2.5. Thành phần, cấu trúc của amylopectin [27].
Phân tử amylopectin có thể chứa đến 100000 đơn vị glucose. Có thể nhận thấy phân tử amylose và amylopectin
Amylopectin là polymer mạch nhánh, ngoài mạch chính có liên kết α-1,4 glicozit còn có nhánh liên kết với mạch chính bằng liên kết α-1,6 glicozit.
Mối liên kết nhánh này làm cho phân tử cồng kềnh hơn, chiều dài của các chuỗi mạch nhánh này khoảng 25-30 đơn vị glucose. Sự khác biệt giữa amylose và amylopectin không phải luôn luôn rõ nét. Bởi lẽ, ở các phân tử amylose cũng thường có một phần nhỏ phân nhánh do đó cũng có những tính chất giống như amylopectin.
1.2.6. Các phản ứng tiêu biểu của tinh bột [26], [27]
1.2.7. Những tính chất vật lý của huyền phù tinh bột trong nước [26], [31]
1.2.8. Độ nhớt của hồ tinh bột
Một trong những tính chất quan trọng của tinh bột có ảnh hưởng đến tính chất và kết cấu của nhiều sản phẩm đó là độ nhớt và độ dẻo. Phân tử tinh bột có nhiều nhóm hydroxyl có khả năng liên kết được với nhau làm cho phân tử tinh bột tập hợp lại, giữ nhiều nước hơn khiến cho dung dịch có độ đặc, độ dính, độ dẻo và độ nhớt cao hơn. Yếu tố chính ảnh hưởng đến độ nhớt của dung dịch tinh bột là đường kính biểu kiến của các phân tử hoặc của các hạt phân tán, đặc tính bên trong của tinh bột như kích thước, thể tích, cấu trúc và sự bất đối xứng của phân tử.
Nồng độ tinh bột, pH, nhiệt độ, tác nhân oxi hóa, các thuốc thử phá hủy liên kết hydro đều làm cho tương tác của các phân tử tinh bột thay đổi do đó làm thay đổi độ nhớt của dung dịch tinh bột.
1.2.9. Khả năng tạo gel và sự thoái hóa gel
Tinh bột sau khi hồ hóa và để nguội, các phân tử sẽ tương tác nhau và sắp xếp lại tạo một cách có trật tự để tạo thành gel tinh bột với cấu trúc mạng 3 chiều. Để tạo được gel thì dung dịch tinh bột phải có nồng độ đậm đặc vừa phải, phải được hồ hóa để chuyển tinh bột thành trạng thái hòa tan và sau đó được để nguội ở trạng thái yên tĩnh. Trong gel tinh bột chỉ có các liên kết hydro tham gia, có thể nối trực tiếp các mạch polyglucode hoặc gián tiếp qua phân tử nước.
Khi gel tinh bột để nguội một thời gian dài sẽ co lại và lượng dịch thể sẽ thoát ra, gọi là sự thoái hóa. Quá trình này sẽ càng tăng mạnh nếu gel để ở lạnh đông rồi sau đó cho rã đông.
1.2.10. Hóa dẻo tinh bột
Người ta thường hóa dẻo tinh bột bằng glycerine. Đây là một rượu đa chức, gồm 3 nhóm -OH gắn vào gốc hyđrocacbon có công thức hóa học là C3H5(OH)3 hay C3H8O3. Glyxerol là một thành phần quan trọng tạo nên chất béo, thuốc nổ nitroglyxerin… Nó có một số tính chất của một rượu đa chức như phản ứng với Cu(OH)2 tạo ra dung dịch xanh trong suốt. Đây cũng là phản ứng đặc trưng để nhận biết rượu đa chức có 2 nhóm -OH trở lên gắn liền kề nhau.
Tính chất hóa học của glyxerol
Glycerine đóng vai trò như là một chất dẻo hóa thông thường trong các màng tinh bột.
Khi tăng hàm lượng Glycerine độ nhớt, nhiệt độ hóa thủy tinh giảm. Vì vậy, khi bổ sung Glycerine vào dung dịch tạo màng tinh bột sẽ làm thay đổi tính chất của màng, mục đích để cải thiện màng. Thường thì cải thiện độ mềm dẻo và độ kéo dãn của màng. Ngoài ra, chất hóa dẻo còn đem lại độ dai và độ dính cho màng. Vì vậy, sử dụng lượng chất hóa dẻo phù hợp sẽ thu được những tính chất màng mong muốn [32], [33].
Ngoài vai trò là một chất hóa dẻo thì Glycerine còn đóng vai trò là một chất giữ ẩm. Việc giữ cho màng được hydrat đảm bảo độ mềm dẻo và độ đàn hồi của màng, khi màng tinh bột ở trong môi trường có độ ẩm tương đối dưới 20 – 25% màng.
b) Màng ngăn ẩm.
c) Màng ngăn khuẩn
1.3. Tổng quan về Axit Citric
Axit citric là một axit hữu cơ thuộc loại yếu và nó thường được tìm thấy trong các loại trái cây thuộc họ cam quít. Nó là chất bảo quản thực phẩm tự nhiên và thường được thêm vào thức ăn và đồ uống để làm vị chua. Ở lĩnh vực hóa sinh thì axít citric đóng một vai trò trung gian vô cùng quan trọng trong quá trình trao đổi chất xảy ra trong các vật thể sống.
Ngoài ra axit citric còn đóng vai trò như là một chất tẩy rửa, an toàn đối với môi trường và đồng thời là tác nhân chống oxy hóa. Axit citric có mặt trong nhiều loại trái cây và rau quả nhưng trong trái chanh thì hàm lượng của nó được tìm thấy nhiều nhất, theo ước tính axit citric chiếm khoảng 8% khối lượng khô của trái chanh.
Trong đề tài này acid citric được sử dụng để đóng rắn màng tinh bột, vì acid citric được coi là một trong những tác nhân liên kết ngang ít độc nhất, có giá thành rẻ và có khả năng tạo liên kết ngang với màng tinh bột.
– Tên theo IUPAC: 2-hydroxypropane -1,2,3-tricarboxylic acid
– Tên thông thường: axit chanh
– Công thức phân tử: C6H8O7 hoặc HOC(COOH)(CH2COOH)2
– Tính axit của Axit citric là do ảnh hưởng của nhóm carboxyl -COOH, mỗi nhóm carboxyl có thể cho đi một proton để tạo thành ion citrat. Các muối citrat dùng làm dung dịch đệm rất tốt để hạn chế sự thay đổi pH của các dung dịch axit.
– Các ion citrat kết hợp với các ion kim loại để tạo thành muối, phổ biến nhất là muối canxi citrat dùng làm chất bảo quản và giữ vị cho thực phẩm. Bên cạnh đó ion citrat có thể kết hợp với các ion kim loại tạo thành các phức dùng làm chất bảo quản và làm mềm nước.
– Với vai trò là một chất phụ gia thực phẩm, axit citric được dùng làm gia vị, chất bảo quản thực phẩm và đồ uống, đặc biệt là nước giải khát. Muối citrat của nhiều kim loại được dùng để vận chuyển các khoáng chất trong các thành phần của chất ăn kiêng vào cơ thể.
Tính chất đệm của các phức citrat được dùng để hiệu chỉnh độ pH của chất tẩy rửa và dược phẩm.
– Được dùng trong công nghệ sinh học và công nghiệp dược phẩm để làm sạch ống dẫn thay vì phải dùng axit nitric.
– Axit citric cũng được cho vào thành phần của kem để giữ các giọt chất béo tách biệt. Ngoài ra nó cũng được thêm vào nước ép chanh tươi.
– Axit citric được coi là an toàn sử dụng cho thực phẩm ở các quốc gia trên thế giới. Nó là một thành phần tự nhiên có mặt ở hầu hết các vật thể sống, lượng dư axit citric sẽ bị chuyển hóa và đào thải khỏi cơ thể.
– Dùng axit citric để tạo liên kết ngang cho tinh bột rất có hiệu quả, liên kết ngang với màng tinh bột độ bền cao hơn màng không hình thành liên kết . Các màng liên kết ngang axit citric có độ thấm nước và hơi thấp hơn so với các màng không liên kết ngang. Sự hình thành cấu trúc chặt chẽ hơn sau khi liên kết ngang ngăn chặn sự trương của tinh bột và cũng hạn chế sự di chuyển của các phân tử, dẫn đến giảm độ thấm hơi nước [34].
1.4. Tổng quan về Natri Hypophotphit
Natri hypophotphit (NaH2PO2, còn có tên natri photphinat) là muối natri của axit photphorơ và thường gặp dưới dạng kết tinh ngậm nước, NaPO2H2·H2O. Natri hypophotphit là một chất rắn ở nhiệt độ phòng, có dạng tinh thể trắng không mùi, tan trong nước và dễ dàng hấp thụ hơi nước trong không khí, phân hủy khi đun nóng và tạo photphin, một khí độc, gây khó chịu cho đường hô hấp.
Natri Hypophotphit dạng tinh thể trắng, hút ẩm.
– Trong dược phẩm: Natri Hypophotphit dùng làm chất chống oxy hóa.
– Thu hồi kim loại màu.
– Thành phần của dung dịch xi mạ điện.
– Natri Hypophotphit là tác nhân xử lý nước.
– Bảo quản thịt.
– Ngăn quá trình đổi màu của polymer.
– Natri Hypophotphit dùng trong sản xuất hóa chất.
– Natri hypophosphite là một chất có tác dụng ức chế sự phát triển của vi khuẩn gram âm gây bệnh và làm hư hỏng thực phẩm được chọn trong môi trường phòng thí nghiệm. Natri hypophosphite có hiệu quả nhất trong việc ức chế sự phát triển của vi khuẩn kỵ khí gram âm, nhưng nói chung là không hiệu quả đối với vi khuẩn hiếu khí Pseudomonas và vi khuẩn Campylobacter jejuni. Nó có tiềm năng như một chất bảo quản thực phẩm kháng khuẩn, vi sinh vật làm hư hỏng thực phẩm chẳng hạn như thịt, cá và các sản phẩm từ sữa là nguyên nhân do vi khuẩn gram âm gây nên [35].
Trong đề tài này Natri Hypophotphit được sử dụng làm chất xúc tác cho phản ứng đóng rắn tinh bột bằng acid citric.
CHƯƠNG 2: THỰC NGHIỆM
2.1. Nội dung thực hiện
Đề tài nghiên cứu gồm 2 giai đoạn, mỗi giai đoạn có những mục tiêu, nhiệm vụ khác nhau, cách thực hiện khác nhau, giai đoạn trước là tiền đề cho giai đoạn tiếp theo và đưa ra kết quả mong muốn cuối cùng.
Giai đoạn 1: Tìm điều kiện tối ưu để đóng rắn màng tinh bột
Giai đoạn 2: Từ điều kiện tối ưu tìm được ở giai đoạn 1, sẽ phối trộn chitosan vào tinh bột với các hàm lượng chitosan trong màng 5%; 10%; 20%.
2.2. Hoá chất và dụng cụ thiết bị
a) Hóa chất:
b) Dụng cụ, thiết bị:
2.3. Tiến hành thực nghiệm
Quy trình tóm tắt tiến trình thực nghiệm chọn điều kiện tối ưu đóng rắn theo sơ đồ 2.1. Glycerol được cho vào tinh bột trước khi hồ hóa, sau giai đoạn hồ hóa tinh bột, tiến hành phối trộn AC và chất xúc tác như đã mô tả ở sơ đồ, đúc màng bằng cách đổ ra đĩa petri, sau đó để màng bay hơi tự nhiên. Khi tạo được màng, lấy ra và tiến hành đóng rắn ở những nhiệt độ và thời gian đã chọn để khảo sát. Chọn màng có độ trương bé nhất, đây chính là điều kiện tối ưu để đóng rắn màng tinh bột.
2.4. Deacetyl hóa chitin
Sử dụng 400g dung dịch NaOH 4M để deacetyl hóa 46g Chitin, khuấy trộn bằng máy khuấy từ và gia nhiệt ở 90°C trong 4h. Sau đó đem lọc rửa chitosan thu được đến khi pH trung tính và sấy khô. Sản phẩm được xác định độ deacetyl hóa bằng phổ hồng ngoại biến đổi Fourier.
2.5. Đo độ trương của màng
Đo độ trương của màng theo thời gian theo Công thức (1). Cách tiến hành: Màng polymer được ngâm trong nước cất, sau một thời gian xác định mẫu được lấy ra, lau khô bề mặt bằng giấy thấm và cân.
2.6. Đo đồ bền kéo đứt của các màng
Đo độ bền kéo được đo theo tiêu chuẩn ASTM D638, tốc độ kéo màng là 1mm/phút. Độ bền kéo của màng được đo tại phòng thí nghiệm polymer trường Đại học Bách Khoa – Đại học Đà Nẵng.
2.7. Phân tích nhiệt trọng lượng (TGA)
TGA được đo trên máy STA 6000 tại phòng thí nghiệm hóa dầu, khoa Hóa, trường Đại học Bách Khoa – Đại học Đà Nẵng.
Khối lượng mẫu đao động từ 4 đến 6 mg, tốc độ gia nhiệt 10 °C/phút, môi trường ni tơ, lưu lượng dòng khí ni tơ là 20 ml/phút.
2.8. Xác định khả năng kháng khuẩn
Kiểm tra mức độ kháng khuẩn của các màng trên vi khuẩn Gram âm (Escherichia coli). Các màng trong đĩa thạch đã cấy sẵn vi khuẩn, sau 12h kiểm tra bằng ngoại quan.
2.9. Xác định độ thấm hơi nước của màng
Độ thấm hơi nước (WVP) được xác định theo phương pháp ASTM E 96-95 (ASTM 1995b). Mẫu màng được cố định lên hộp nhôm có chứa sẵn silicagen bên trong để giữ độ ẩm ban đầu bên trong hộp là 0%. Sau đó đặt vào bình hút ẩm có điều chỉnh độ ẩm tương đối của môi trường trong bình 50±5% bằng dung dịch muối Mg(NO3)2 bão hòa. Tiến hành đo sau mỗi 12 giờ trong 6 ngày để biết lượng hơi nước hấp thụ qua màng.
2.10. Khảo sát khả năng phân hủy sinh học
Mẫu được chôn trong đất ngoài môi trường tự nhiên và định kỳ được lấy lên để quan sát sự thay đổi ngoại quan.
CHƯƠNG 3: KẾT QUẢ VÀ THẢO LUẬN
3.1. Deacetyl hóa chitin
3.1.1. Deacetyl hóa
Chitosan được tạo ra bằng cách deacetyl hóa chitin. Quá trình deacetyl hóa được gia nhiệt để tăng hiệu suất phản ứng. Sản phẩm thu được có màu vàng nâu như Hình 3.1.

Mức độ deacetyl hóa được xác định bằng phổ hồng ngoại biến đổi Fourier
Hình 3.2: Phổ FTIR của chitosan
3.1.2. Ảnh hưởng màu chitosan đến màng
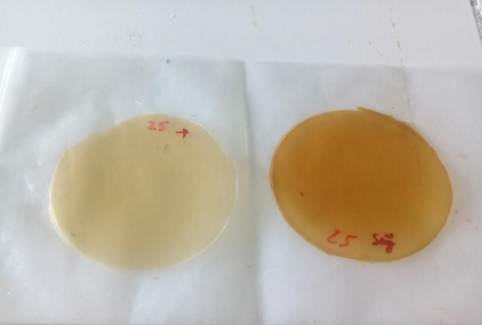
Màu của chitosan có ảnh hưởng đến màu của màng sau khi đúc. Hình 3.3 là màng tinh bột, màng này gần như trong suốt. Tuy nhiên, sau khi phối trộn với chitosan thì màu của màng thu được chuyển sang màu vàng.


a b
Hình 3.3: (a) Màng tinh bột và (b) màng chitosan
Ngoài ra, thực nghiệm còn cho thấy màng có chitosan trước khi sấy sẽ có màu nhạt hơn so với sau khi sấy (Hình 3.4)
Hình 3.4: Màng tinh bột/chitosan chưa và đã đóng rắn ở 150°C
3.2. Các yếu tố ảnh hưởng đến quá trình đóng rắn màng tinh bột
3.2.1. Ảnh hưởng của hàm lượng acid citric (AC)
Để khảo sát ảnh hưởng của hàm lượng AC đến mức độ đóng rắn của tinh bột thì tinh bột được phối trộn với AC với các hàm lượng khác nhau rồi đóng rắn ở 150°C trong 30 phút. Sản phẩm thu được được đo độ trương. Kết quả thể hiện trên đồ thị Hình 3.5
Hình 3.5: Độ trương của màng tinh bột tại nhiệt độ đóng rắn 150°C trong 30 phút.
Từ kết quả thể hiện trên đồ thị, khi thay đổi hàm lượng AC (1, 3, 5 %) thì độ trương của màng tinh bột cũng bị ảnh hưởng, màng tinh bột chứa 5% AC so với các màng có hàm lượng AC 1 và 3 % trương ít hơn. Tốc độ trương ban đầu của các mẫu là giống nhau. Đối với màng AC 1% độ lệch chuẩn lớn hơn so với 2 màng còn lại. Nguyên nhân có thể là do tính đồng nhất về mật độ liên kết ngang trong mẫu kém. Tuy độ trương của mẫu chứa 5% AC là thấp nhất nhưng mức độ trương của nó cũng khá lớn, lên đến 85%, đồng thời, thời gian đạt đến mức độ trương bảo hòa cũng rất ngắn, khoảng hơn 10 phút.
AC được sử dụng để tạo liên kết ngang cho tinh bột. Vì vậy khi hàm lượng AC tăng lên làm cho mật độ liên kết ngang trong mẫu sau khi đóng rắn tăng lên, từ đó dẫn đến chiều dài đoạn mạch polymer giữa 2 liên kết ngang giảm xuống, điều này kéo theo khả năng trương của polymer đóng rắn giảm xuống. Ở hướng ngược lại, đối với các polymer có khả năng tan trong nước thì việc đánh giá mật độ liên kết ngang thông qua xác định độ trương của nó theo phương pháp ngâm trực tiếp vào nước có thể cho kết quả không chính xác. Sở dĩ như vậy là do trong quá trình ngâm một phần polymer có thể tan vào nước làm cho độ trương biểu kiến xác định được trở nên thấp hơn đối với những mẫu có mật độ liên kết ngang thấp hơn. Tuy nhiên, ở nghiên cứu này sự biến đổi độ trương của các mẫu phù hợp với logic về ảnh hưởng của của hàm lượng chất đóng rắn đến mật độ liên kết ngang như đã nói ở trên. Do đó ảnh hưởng về sự hòa tan của tinh bột (nếu có) trong quá trình đo độ trương không đủ lớn để làm sai lệch kết luận được rút ra từ kết quả thực nghiệm. Với mong muốn tạo ra màng tinh bột có khả năng trương trong nước bé nên hàm lượng AC 5% được lựa chọn cho nghiên cứu tiếp theo.
3.2.2. Ảnh hưởng của thời gian đóng rắn
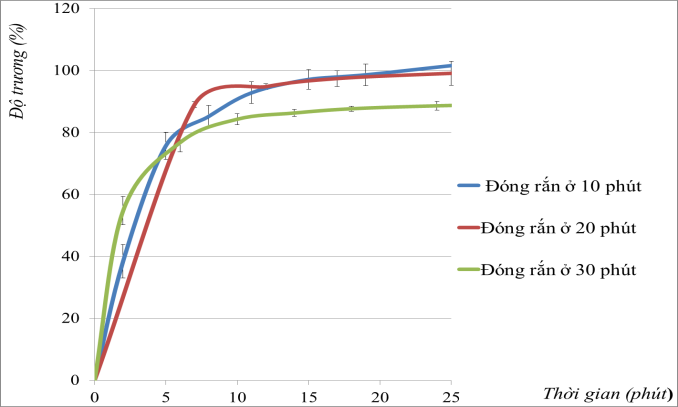
Để khảo sát thời gian đóng rắn của màng tinh bột, nồng độ AC được cố định 5%, nhiệt độ là 150°°C và thay đổi thời gian đóng rắn lần lượt 10; 20; 30 phút. Kết quả thu được thể hiện qua đồ thị Hình 3.6.
Hình 3.6: Ảnh hưởng của thời gian đóng rắn đến độ trương
Từ đồ thị cho thấy, cùng một hàm lượng AC (5%) và chất xúc tác, được sấy ở cùng một nhiệt độ, nhưng khi thay đổi thời gian sấy sẽ ảnh hưởng đến khả năng trương của màng tinh bột. Khi thời gian đóng rắn là 10 phút và 20 phút thì sản phẩm thu được có độ trương lớn hơn so với thời gian đóng rắn 30 phút. Điều này có thể do khi thời gian đóng rắn ngắn thì mật độ liên kết ngang hình thành chưa đủ lớn làm cho độ trương của sản phẩm tăng. Mẫu đóng rắn ở 30 phút tuy có độ trương bảo hòa thấp hơn 2 mẫu còn lại nhưng tốc độ trương lúc đầu của nó lại cao hơn so với 2 mẫu còn lại. Từ kết quả thực nghiệm chọn thời gian đóng rắn là 30 phút.
3.2.3. Ảnh hưởng của nhiệt độ đóng rắn
Màng tinh bột với cùng 1 hàm lượng AC (5%) được đóng rắn ở cùng thời gian 30 phút nhưng các ở nhiệt độ khác nhau được biểu diễn qua đồ thị Hình 3.7
Hình 3.7: Ảnh hưởng vào nhiệt độ đóng rắn đến độ trương
Từ kết quả khảo sát thực nghiệm ta thấy ngoài các yếu tố ảnh hưởng đã đề cập khảo sát ở trên, độ trương của màng còn phụ thuộc vào nhiệt độ đóng rắn màng: cùng một hàm lượng AC và thời gian đóng rắn, nhưng thay đổi nhiệt độ là 120°C và 150°C thì tại nhiệt độ đóng rắn cao hơn màng có độ trương ít hơn. Từ đồ thị Hình 3.7 ta cũng thấy ban đầu chưa thấy rõ sự khác biệt độ trương hai màng, nhưng một thời gian ta thấy nhiệt độ thấp hơn màng trương nhiều hơn.
Kết luận: Từ các kết quả khảo sát của thực nghiệm ta thấy màng tinh bột có hàm lượng AC 5% và đóng rắn ở 150°C trong 30 phút sẽ có độ trương bé nhất. Điều kiện đóng rắn này sẽ được sử dụng để chế tạo màng tinh bột phối hợp với chitosan.
3.3. Ảnh hưởng của hàm lượng chitosan đến độ trương của màng
Hình 3.8: Đồ thị biểu hiện độ trương của các loại màng
Sau khi phối trộn chitosan vào màng tinh bột và tiến hành đóng rắn ở điều kiện tìm ra ở trên, các mẫu thu được được đo độ trương. Kết quả độ trương thể hiện trên Hình 3.8.
Màng tinh bột chưa được đóng rắn trương rất nhanh và khi chưa đạt bảo hòa thì màng đã bị rách nên không thể tiếp tục đo được. Nếu dùng AC đóng rắn thì màng sẽ được cải thiện hơn về độ bền, trong quá trình đo mẫu không bị rách.
Khi phối hợp tinh bột với chitosan thì tính hút nước của màng giảm xuống. Điều này là do tính kỵ nước của chitosan cao hơn so với tinh bột đã hồ hóa. Do đó khi hàm lượng chitosan trong màng tăng thì độ trương của màng giảm xuống. Với màng có chứa 20% chitosan thì độ trương bảo hòa nhỏ hơn 60%, giảm hơn 25% so với màng tinh bột không có chitosan.
3.4. Tính chất cơ lý
Tính chất cơ lí của các màng thể hiện qua độ bền kéo Hình 3.9. Kết quả đo độ bền kéo cho thấy màng tinh bột chưa đóng rắn (màng tinh bột) có độ bền kéo cao hơn màng sau khi đã đóng rắn. Hiện tượng này cũng đã được quan sát thấy bởi Yu và cộng sự [37], tuy nhiên họ không đưa ra giải thích. Đây là điều bất thường vì không phù hợp với quy luật chung cũng như không giống với một số nghiên cứu đã được công bố. Nguyên nhân có thể là do mẫu tinh bột đóng rắn hút ẩm nhiều hơn mẫu tinh bột không đóng rắn trước khi đo độ bền kéo hoặc do sai sót trong quá trình chuẩn bị mẫu kéo. Khi đưa chitosan vào màng thì độ bền của màng được cải thiện. Hàm lượng chitosan càng cao thì màng càng bền.
Hình 3.9: Độ bền kéo đứt của màng
3.5. Sự phân hủy nhiệt
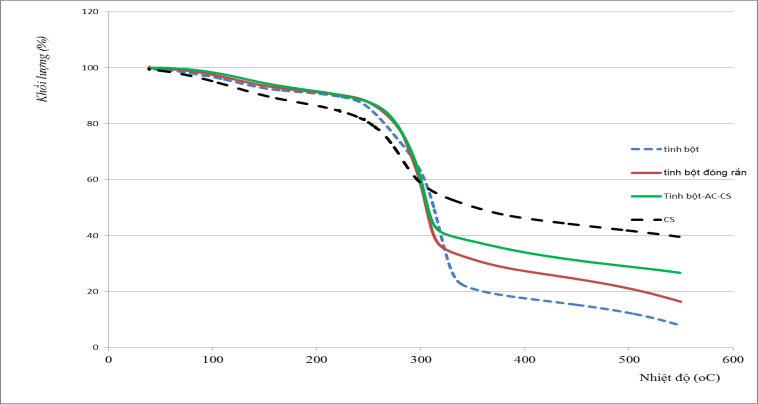
Kết quả phân tích nhiệt trọng lượng thể hiện ở Hình 3.10. Sự phân hủy của tinh bột không đóng rắn trải qua 3 giai đoạn. Giai đoạn 1 ở nhiệt độ nhỏ hơn 150°C, giai đoạn 2 từ 150 °C đến 270°C và giai đoạn 3 từ 270°C đến 330°C. Theo Renato Queiroz Assis và cộng sự [13], giai đoạn 1 là sự bay hơi của nước, đồ thị cho thấy hàm lượng nước trong màng khoảng 10%, giai đoạn 2 là sự phân hủy của glycerin và một phần tinh bột và giai đoạn 3 là sự phân hủy của tinh bột. Với tinh bột đóng rắn thì không thấy xuất hiện giai đoạn 2 như trong trường hợp tinh bột không đóng rắn và quá trình phân hủy chỉ còn lại 2 giai đoạn. Điều này có thể do có sự mất mát của glycerin trong quá trình đóng rắn hoặc sự tham gia phản ứng của glycerin với tác nhân đóng rắn để chuyển thành các hợp chất có khối lượng phân tử cao hơn. Lượng chất còn lại sau quá trình phân hủy cũng tăng lên khi có sử dụng tác nhân đóng rắn. Điều này là do khi tiến hành đóng rắn tinh bột có sử dụng NaH2PO2, là hợp chất vô cơ có chứa kim loại. Na và các hợp chất của Na sẽ không bay hơi trong điều kiện thí nghiệm. Khi phối hợp chitosan vào thì dạng đường cong TGA và các khoảng nhiệt độ phân hủy không thay đổi so với trường hợp tinh bột đóng rắn, tuy nhiên độ mất khối lượng của giai đoạn 2 giảm xuống. Sở dĩ như vậy là do chitosan phân hủy một phần nhỏ trong giai đoạn này. Điều này cũng dẫn đến khối lượng mẫu còn lại sau khi phân hủy tăng lên.
3.6. Sự thấm hơi nước
Độ thấm hơi nước của màng được tính theo công thức 2. Sự thay đổi khối lượng cốc theo thời gian được thể hiện trên Hình 3.11. Hệ số góc của các phương trình trong Hình 3.11 là giá trị w/t trong công thức 2. Diện tích cốc sử dụng là 0,002376 m2 (đường kính 55 mm). Từ công thức 2 tính được độ thấm hơi nước qua màng (Bảng 3.1). Bảng 3.1 cho thấy độ thấm hơi nước của màng tinh bột gần như không bị ảnh hưởng bởi việc đóng rắn tinh bột. Giá trị độ thấm hơi nước của màng tinh bột không đóng rắn và có đóng rắn bằng nhau. Khi phối hợp tinh bột với chitosan, ở hàm lượng 5% chitosan thì độ thấm hơi nước giảm xuống, nhưng khi tăng hàm lượng chitosan lên 10 và 20% thì độ thấm hơi nước lại tăng lên, đạt giá trị hơi cao hơn so với trường hợp màng tinh bột nguyên. Tuy nhiên, nhìn chung thì các kết quả thu được không khác nhau nhiều. Độ thấm hơi nước ngoài phụ thuộc cấu trúc, thành phần hóa học còn phụ thuộc vào chiều dày màng, giảm khi chiều dày màng tăng. Yu Xianda và cộng sự [38] đã nghiên cứu ảnh hưởng của chiều dày màng PVA đến độ thấm hơi nước và thấy rằng khi chiều dày màng đạt trên 50 micromet thì tốc độ thay đổi độ thấm hơi nước theo chiều dày màng trở nên rất bé. Ở nghiên cứu này sử dụng màng có chiều dày tương đối lớn nên giá trị độ thấm hơi nước thu được bé, do đó không thấy rõ được ảnh hưởng của thành phần hóa học của màng đến độ thấm hơi nước. Trường hợp màng chứa 5% chitosan cũng khó kết luận vì chưa kiểm tra được tính lặp lại.
Hình 3.11: Sự thay đổi khối lượng cốc theo thời gian
Bảng 3.1: Độ thấm hơi nước của màng
| Tinh bột không chứa chitosan | Tinh bột có chứa chitosan (có đóng rắn) | ||||
| Không đóng rắn | Đóng rắn | 5% | 10% | 20% | |
| Chiều dày màng (mm) | 0,244 ± 0,015 | 0,154 ± 0,009 | 0,21 ± 0,012 | 0,238 ± 0,009 | 0,258 ± 0,019 |
| Độ thấm hơi nước (g/m2.h) | 3,41 | 3,41 | 2,86 | 3,62 | 3,49 |
3.7. Khả năng kháng khuẩn
Hình 3.12: Khả năng kháng khuẩn của màng (a) tinh bột đóng rắn
và (b) tinh bột phối trộn 10% chitosan
Tính chất kháng khuẩn của màng được thử nghiệm trên vi khuẩn gram âm Escherichia coli. Trước khi đặt vào đĩa thạch đã cấy vi khuẩn, các màng được ngâm trong nước cất và thay nước cho đến khi pH của nước ngâm đạt 6,8 đến 7,2 nhằm loại bỏ hết acid trong màng. Hình 3.12 cho thấy có một vòng kháng khuẩn xuất hiện xung quanh màng có chứa chitosan, trong khi đối với màng không chứa chitosan thì không có. Như vậy khi đưa chitosan vào màng thì màng sẽ có khả năng kháng khuẩn gram âm. Có 2 cơ chế kháng khuẩn được đề nghị đối với chitosan. Cơ chế thứ nhất cho rằng khả năng chống vi khuẩn của chitosan xuất phát từ bản chất polycationic của nó [39].
Khi có mặt acid, nhóm NH2 sẽ bị proton hóa, điện tích dương của nhóm amino sẽ tương tác với phần mang điện âm của màng tế bào vi khuẩn làm thay đổi tính chất barrier của chúng nên ngăn cản sự đi vào của dưỡng chất và/hoặc gây ra sự giảm nội bào. Cơ chế thứ 2 cho rằng sự kháng khuẩn có liên quan đến việc thấm chitosan KLPT thấp vào bên trong tế bào, liên kết với DNA và kết quả là ức chế sự tổng hợp RNA và protein [40]. Như vậy, có thể kết luận khả năng kháng khuẩn của chitosan trong nghiên cứu này xảy ra theo cơ chế thứ 2.
3.8. Khảo sát phân hủy sinh học
Các màng được chôn trong đất tại khu vực trường Đại học Bách Khoa, Đại học Đà Nẵng để khảo sát khả năng phân hủy sinh học của chúng. Tuy nhiên, do độ bền màng không cao nên sau 10 ngày chôn lấp các màng đã bị phá hủy cơ học (Hình 3.13), vì vậy không thể tiếp tục khảo sát.
Hình 3.13: Các màng tinh bột chứa 0, 5, 10 và 20% (từ trái qua phải) trước khi chôn (phía trên) và sau khi khôn trong đất 10 ngày (phía dưới)
KẾT LUẬN
Từ những nội dung nghiên cứu thực tế đã trình bày, luận văn đã góp phần làm rõ một số vấn đề khoa học về việc nghiên cứu kết hợp 2 loại polyme tự nhiên là chitosan và tinh bột tạo màng làm màng bao thực phẩm. Luận văn đã giải quyết được những vấn đề sau:
– Đã tìm được điều kiện tối ưu đóng rắn cho màng tinh bột: hàm lượng acid citric 5% so với khối lượng tinh bột, hàm lượng xúc tác 50% so với acid citric, được đóng rắn ở 150 0C trong 30 phút.
– Độ bền kéo của màng tinh bột đóng rắn nhỏ hơn so với màng không đóng rắn
– Việc phối hợp chitosan vào tinh bột tạo ra màng có tính ít hút nước hơn, độ bền kéo tăng lên và có khả năng kháng vi khuẩn gram âm Escherichia coli.
KIẾN NGHỊ
– Khảo sát khả năng bảo vệ của màng đối với một số loại thực phẩm khô.
– Tăng cường độ bền màng bằng cách thêm vào một polymer thứ 3, ví dụ polyvilylalcohol.
Do một số nguyên nhân khách quan và chủ quan, mặc dù bản thân đã hết sức cố gắng khắc phục khó khăn để hoàn thành luận văn, nhưng kết quả nghiên cứu không tránh khỏi những thiếu sót. Kính mong được sự đóng góp ý kiến của quí thầy cô và các bạn để luận văn được hoàn thiện hơn.
E:\DỮ LIỆU COP CỦA CHỊ YẾN\DAI HOC DA NANG\KY THUAT HOA HOC\KHOA 35\(R)2. Huynh Thi Thu Dieu\TOM TAT