Nghiên cứu sản xuất chế phẩm vi sinh để xử lý bã thải mùn cưa sau trồng nấm làm thức ăn nuôi trùn quế
Trong những năm gần đây, cùng với sự phát triển cơ sở hạ tầng đô thị tại thành phố Đà Nẵng, đất nông nghiệp cũng ngày càng thu hẹp, nhiều hộ nông dân đã chuyển sang nuôi trồng các loại nấm ăn (nấm sò, nấm rơm…) và nấm dược liệu (nấm linh chi) để cải thiện kinh tế. Những mô hình nuôi trồng nấm trong nhà hiện nay sử dụng mùn cưa làm nguyên liệu, đã thải ra một lượng lớn bã thải sau trồng nấm nhưng chưa có biện pháp xử lý triệt để.
Bên cạnh đó, trong nông nghiệp, trùn quế được xem là loại thức ăn giàu đạm cao cấp, bổ dưỡng cho gia súc, gia cầm. Phân trùn quế cũng được đánh giá là một chế phẩm phân hữu cơ sinh học rất tốt cho nhiều loại cây trồng, sử dụng thay thế phân vô cơ, như là giải pháp để sản xuất các loại rau sạch, an toàn. Tuy nhiên việc nuôi trùn quế hiện nay chủ yếu bằng phân tươi của động vật, gây nhiều trở ngại trong quá trình nuôi trùn quế với những vấn đề về vệ sinh và ô nhiễm môi trường.
Đã có một số nghiên cứu trên thế giới chứng minh giải pháp nuôi trùn quế sử dụng thức ăn là bã thải mùn cưa sau khi trồng nấm là hoàn toàn khả thi [1][2]. Vấn đề đặt ra là các VSV thực hiện quá trình lên men xử lý loại bã thải này là nguồn tự phát trong đống ủ nên hiệu quả quá trình xử lý là không ổn định và khó kiểm soát khi ứng dụng trên qui mô lớn. Vì thế nhóm nghiên cứu chúng tôi quyết định thực hiện đề tài: “Nghiên cứu sản xuất chế phẩm vi sinh để xử lý bã thải mùn cưa sau trồng nấm làm thức ăn nuôi trùn quế (Perionyx excavatus)” nhằm chủ động điều khiển quá trình xử lý loại bã thải này thành nguồn thức ăn có thể dùng để nuôi trùn quế, nâng cao hiệu quả kinh tế cho nghề trồng nấm.
Đề tài được thực hiện với 2 mục tiêu cụ thể:
- Chọn lựa một số chủng VSV có khả năng phân hủy cellulose và ưa nhiệt phù hợp xử lý bã thải mùn cưa sau trồng nấm.
- Xác định các thông số công nghệ để sản xuất chế phẩm vi sinh từ các chủng đã được chọn trong quy mô pilot.
3.1. Đối tượng nghiên cứu
– Các nguồn bã thải mùn cưa sau khi trồng nấm nấm sò
– Các giống VSV phân huỷ cellulose và ưa nhiệt
3.2. Phạm vi nghiên cứu
– Nghiên cứu thực hiện ở quy mô phòng thí nghiệm và thử nghiệm ứng dụng trong điều kiện thực tế tại Đà Nẵng
4.1. Cách tiếp cận
– Thu thập các nguồn nguyên liệu là bã thải mùn cưa sau khi đã trồng nấm sò tại Đà Nẵng
– Tiến hành xử lý nguyên liệu theo phương pháp ủ men Takakura
– Phân lập và tuyển chọn các VSV phân huỷ cellulose cao và có tính ưa nhiệt từ đống ủ đang lên men, làm cơ sở để nghiên cứu phát triển thành chế phẩm vi sinh, phục vụ cho việc xử lý bã thải sau trồng nấm thành thức ăn để nuôi trùn quế.
4.2. Phương pháp nghiên cứu
– Phân lập và tuyển chọn các chủng VSV có khả năng phân huỷ cellulose trên môi trường khoáng cơ bản chứa nguồn carbon duy nhất là CMC.
– Chọn lọc các chủng ưa nhiệt bằng cách nuôi cấy ở các điều kiện nhiệt độ khác nhau và xác định số lượng tế bào VSV còn sống ở các thử nghiệm.
– Đánh giá các yếu tố ảnh hưởng đến việc nhân sinh khối của các chủng VSV được chọn làm chế phẩm bằng cách so sánh tốc độ phát triển của VSV trong các thử nghiệm.
– Đánh giá chọn lựa loại chất mang phù hợp cho VSV trong chế phẩm thông qua tỉ lệ sống của VSV sau thời gian bảo quản chế phẩm (1 tháng)
– Đánh giá hiệu quả sử dụng chế phẩm thông qua khả năng tiêu thụ loại thức ăn này khi nuôi trùn quế.
+ Cung cấp dữ liệu khoa học về một số chủng VSV tiềm năng sinh ra eyme cellulase và ưa nhiệt từ đống ủ bã thải mùn cưa được ủ theo phương pháp Takakura.
+ Cung cấp thông số công nghệ cho việc sản xuất chế phẩm vi sinh từ bã thải mùn cưa sau trồng nấm.
- Ý nghĩa thực tiễn
+ Cung cấp dữ liệu, thông số làm nền để nâng cấp quy mô sản xuất chế phẩm vi sinh từ quy mô pilot lên quy mô công nghiệp.
CHƯƠNG 1
TỔNG QUAN
Phương pháp ủ phân Takakura – Takakura Composting Method (TCM), được phát triển bởi Koji takakura, được giới thiệu lần đầu tại thành phố Kitakyushu, Nhật Bản và sau đó lan rộng ra nhiều thành phố trên thế giới [3]. Đây là một phương pháp tận dụng nguồn bã thải trái cây, rỉ đường, các sản phẩm lên men hỏng để tạo ra dung dịch men có khả năng tương tự chế phẩm vi sinh cung cấp nguồn VSV phân giải chất hữu cơ.
Đã có nhiều nghiên cứu được tiến hành để phân lập dòng VSV sản sinh enzymee phân giải cellulose và khả năng phân giải cellulose của chúng. Các VSV phân giải cellulose chủ yếu được phân lập từ hệ tiêu hóa động vật ăn cỏ như bò, cừu, dê [19], và côn trùng như bọ cánh cứng, mối [20][21]. Ngoài ra chúng còn được tìm ra trong phân ủ, phân hữu cơ, bùn từ nước thải [18].
Chế phẩm vi sinh là một loại sản phẩm có chứa các VSV sống với những hoạt tính sinh học nhất định. Chế phẩm có thể ở dạng rắn hay lỏng tuỳ theo nhu cầu sản xuất. Thông thường chế phẩm dạng rắn có thời gian bảo quản dài hơn so với dạng lỏng [36].
Để sản xuất chế phẩm vi sinh, hỗn hợp các VSV được chọn lựa theo mục đích sử dụng sẽ được lên men nhân sinh khối gọi là nhân giống sản xuất. Để tạo thành chế phẩm dạng rắn, hỗn hợp VSV sẽ được phối trộn cùng chất mang đã được khử trùng. Các chất mang thường được sử dụng như cao lanh, than bùn, xơ dừa… Các chất mang vừa là nền để sinh khối VSV bám vào; đồng thời cũng là nguồn dinh dưỡng để duy trì sự sống của VSV trong thời gian bảo quản chế phẩm [37].
Giun quế (Perionyx excavatus Perrier. 1872) sinh trưởng và phát triển khá phổ biến ở vùng nhiệt đới châu Á. Giun quế có kích thước tương đối nhỏ, có màu từ đỏ đến mận chín, cơ thể có hình trụ thuôn dài gồm nhiều đốt nối với nhau.
 |
Bảng 1.1. Một số lợi ích từ trùn quế và phân trùn quế
| Hợp chất/sản phẩm | Hoạt tính/Lợi ích | Đối tượng tác dụng | Cơ chế | Tài liệu tham khảo |
|---|---|---|---|---|
| Phân trùn quế | Cải tạo đất trồng | Đất đai Cây trồng | – Tăng lượng đạm – Cung cấp các VSV phân giải | [39] [40] [41] |
| Kích thích tăng trưởng cây trồng | ||||
| Chống xói mòn | ||||
| Điều hòa môi trường đất | ||||
| Kiểm soát sâu hại | ||||
| Tăng giữ nước | ||||
| Dịch trùn quế | Chống ung thư | SCC-9 (tế bào ung thư biểu mô lưỡi) | – Đứt gãy DNA – Dừng chu kì tế bào – Gây ra apotosis (chết theo chương trình) | [42] |
| Nuôi cấy tế bào động vật | Dòng tế bào HeLa chuột | [43] | ||
| Protein thô | Gây độc tế bào | – L-929 (tế bào nguyên bào sợi của chuột) – HepG-2 (tế bào ung thư biểu mô tế bào gan ở người) | [44] | |
| Chống oxy hóa | ||||
| Sinh khối giun đất kết tủa aceton | Chống đông máu | [44] |
- Phương pháp nuôi trùn quế
- Theo cách thức nuôi
- Phương pháp nuôi trùn quế
a. Nuôi trong chậu
b. Nuôi trên đồng ruộng có mái che
c. Nuôi trên đồng ruộng không có mái che
d. Nuôi trong nhà với quy mô công nghiệp và bán công nghiệp
1.4.2.2. Theo nguồn thức ăn
a. Phân bò
b. Chất thải trong công nghiệp sản xuất gum
c. Bã thải sau quá trình sản xuất tinh dầu xả
d. Các chất thải hữu cơ như las, rơm rạ, xơ dừa

- Tổng quan tình hình nghiên cứu trong và ngoài nước có liên quan đến đề tài
Tại Quảng Nam hiện nay, việc tái sử dụng bã thải mùn cưa sau trồng nấm chỉ ở dạng tự phát. Hầu hết các hộ nuôi trồng nấm không có thời gian quan tâm đến lượng bã thải này.
Trong khi đó, ở các địa phương khác trong nước đã có một số hướng quan tâm tận dụng nguồn bã thải này như:
- Lê Duy Thắng, Trần Hoàng Dũng, Trường Đại học Khoa học Tự nhiên TP. HCM đã nghiên cứu và tận dụng nguồn bã thải trồng nấm rơm sau trồng nấm để nuôi trùn quế.
- Tại Đà Nẵng vào năm 2010, tác giả Lê Văn Thông đã tiến hành nghiên cứu, xây dựng quy trình xử lý rơm thải sau trồng nấm rơm làm phân hữu cơ vi sinh bằng phương pháp ủ bể có đảo trộn.
Như vậy ở trong nước cũng đã có một số giải pháp để xử lý bã thải nấm. Tuy nhiên vẫn còn ở quy mô nhỏ lẻ và chưa có các công bố khoa học cụ thể, đặc biệt trong hướng xử lý bã thải sau trồng nấm thành thức ăn để nuôi trùn quế.
Trên thế giới cũng đã có một số nghiên cứu ghi nhận về việc xử lý các phế liệu giàu cellulose làm thức ăn để nuôi trùn quế. Đặc biệt, nhóm nghiên cứu của Tajbakhsh (2008) đã tái sử dụng bã thải mùn cưa sau trồng nấm để nuôi giun đất [52]. Đây là cơ sở khoa học để nhóm nghiên cứu tiếp tục cải tiến phương pháp ủ để có thể xử lý hiệu quả bã thải mùn cưa sau trồng nấm làm nguyên liệu nuôi trùn quế.
CHƯƠNG 2
VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Nguyên liệu mùn cưa thải sau khi được đưa về, mang đi bóp vụn cho đồng đều. Tiến hành phơi từ 1-2 nắng để diệt đi thành phần VSV tồn tại trong bã thải mùn cưa.
 |
- Bã trái cây
Bã trái cây được lấy từ tiệm nước ép trái cây chợ Mới, Đà Nẵng. Bã trái cây đã được nghiền vụn, mịn, chủ yếu là cà rốt, cóc, dứa, ổi, táo…
 |
- Phương pháp nghiên cứu
Các phương pháp nghiên cứu tương ứng sẽ được trình bày cụ thể theo sơ đồ sau.
| Phân lập và tuyển chọn chủng VSV phân hủy cellulose và ưa nhiệt Khảo sát các điều kiện để nhân sinh khối của chủng VSV được chọn Khảo sát các điều kiện tạo chế phẩm vi sinh Hình 2.3 Sơ đồ bố trí các thí nghiệm Đánh giá chế phẩm Tỷ lệ hỗn hợp dịch VSV : chất mang Chất mang Tỷ lệ phối trộn VSV pH Nhiệt độ Môi trường Thời gian Bã thải mùn cưa Men đường Men muối Bã trái cây |
- Ủ bã thải nấm theo phương pháp Takakura
* Tiến hành:
Men muối: Hòa tan 4g muối vào 2l nước rồi trộn đều với 2kg bã trái cây.
Men đường: Dùng pipet hút 67,5ml yakult hòa với 90g sữa chua cùng với 16,88g rỉ đường và 16,88g men bánh mì.
Sau khi đã ủ xong men đường và men muối. Tiến hành trộn đều men đường: men muối: bã nấm theo tỉ lệ 1:4:5(g/g).
 Hình 2. 1 Men muối ủ 3 ngày |  |
Phân lập và tuyển chọn chủng VSV phân hủy ellulose và ưa nhiệt [63]
2.2.2.1. Phân lập và tuyển chọn các vsv phân huỷ cellulose mạnh
a. Phân lập chủng VSV phân hủy cellulose
* Tiến hành:
Sử dụng môi trường chọn lọc chỉ chứa một nguồn cacbon duy nhất là
CMC để phân lập các chủng VSV sinh enzymee cellulase.
b. Tuyển chọn chủng VSV phân hủy cellulose mạnh [62] [65]
* Tiến hành:
Cấy chấm điểm các chủng VSV đã phân lập và làm thuần được trên môi trường CMC, nuôi ủ ở 37⁰C trong vòng 48h. Sau thời gian nuôi, đổ thuốc nhuộm lugol vào đĩa môi trường. Sau khoảng 1 phút, vòng phân giải xuất hiện, tiến hành đo kích thước vòng phân giải rồi tính hiệu số giữa đường kính vòng phân giải (D1) và đường kính khuẩn lạc (d1).
Chọn các chủng có hiệu số
c. Tuyển chọn những chủng có sinh enzymee cellulase mạnh và có khả năng ưa nhiệt [66]
*Tiến hành: Tăng sinh các chủng trong môi trường dinh dưỡng LB [64] ở nhiệt độ 37⁰C trong vòng 24h. Sau đó, hút 100μl dịch VSV cấy trãi trên môi trường CMC, nuôi ủ ở các mức nhiệt độ khác nhau 50⁰C, 55⁰C và 60⁰C để thăm dò khả năng ưa nhiệt của các chủng VSV sinh cellulase đã có.
d. Kiểm tra tính đối kháng giữa các chủng VSV đã chọn [68][69]
*Tiến hành: Trên môi trường thạch LB, cấy chấm điểm 2 chủng BU01 và BU06 cách nhau 2cm, nuôi ủ ở 37⁰C trong 72h, quan sát sự phát triển của VSV và phần tiếp giáp giữa hai khuẩn lạc.
e. Định danh chủng VSV được chọn
Dựa vào đặc điểm hình thái, sinh lý và sinh học phân tử để định danh các chủng VSV được chọn lựa.
- Khảo sát điều kiện nhân sinh khối các chủng VSV được chọn [37][70][71]
- Môi trường lên men thu sinh khối
Chủng VSV được nuôi trong các ống nghiệm chứa môi trường khảo sát. Nhiệt độ trong quá trình lên men sinh khối: 37⁰C; thời gian lên men: 72 giờ. Sau 72h, tiến hành đo OD600 của dịch nuôi ở các nồng độ pha loãng và thực hiện cấy trang trên môi trường SX1, SX2 ở các nồng độ vừa pha loãng. Môi trường lên men sinh khối phù hợp khi mật độ tế bào VSV là cao nhất và hoạt tính sinh học của VSV phải ổn định.
Bảng 2.1. Môi trường lên men sinh khối BU01 và BU06 [60][37]
| SX1 | SX2 |
| Rỉ đường: 20g/l | Pepton: 20g/l |
| Cao nấm men: 10g/l | Cao nấm men: 10g/l |
| K2HPO4:0.2g/l | Glucose: 1g/l |
- Khảo sát ảnh hưởng của nhiệt độ:
* Tiến hành:
Chuẩn bị 6 bình môi trường vừa được chọn, chỉnh pH= 7, khử trùng ở 121⁰C trong 15 phút. Hút 1ml dịch VSV cho vào các bình môi trường. Đối với chủng BU01 tiến hành nuôi lắc ở các mức nhiệt độ: 20⁰C, 30⁰C, 40⁰C, 50⁰C, 60⁰C. Và với chủng BU06 tiến hành nuôi ở các mức nhiệt độ tương tự nhưng không lắc.
c. Khảo sát ảnh hưởng của pH:
* Tiến hành:
Chọn môi trường và nhiệt độ tối ưu từ 2 khảo sát trên, thay đổi pH môi trường nuôi cấy: 5,5; 6; 6,5; 7,0; 7,5. Tiến hành nuôi 2 chủng BU01 và BU06 trong 72h sau đó đo OD600 của từng nghiệm thức nuôi cấy.
- Khảo sát điều kiện tạo chế phẩm vi sinh
a. Xác định chất mang
* Tiến hành:
Tiến hành phối trộn dịch sinh khối vào 3 loại chất mang là cao lanh (xin mẫu tại khoa Xây Dựng – Đại học Bách Khoa Đà Nẵng), cám gạo (thu mua tại chợ Mới Hòa Thuận Đà Nẵng), và bã thải mùn cưa trồng nấm theo tỉ lệ 1:10 (ml/g). Các chất mang đều được hấp khử trùng 121⁰C trong 30 phút. Cho vào túi ni lông hàn kín. Kiểm tra mật độ VSV tại thời điểm chưa phối trộn để so sánh với mật độ của các chủng sau 30 ngày phối trộn vào chất mang bằng cách cấy trang 1ml dịch VSV trên môi trường tối ưu, sau 24h và đếm số khuẩn lạc.
b. Xác định tỷ lệ phối trộn 2 chủng VSV trong chế phẩm
* Tiến hành:
Tiến hành phối trộn dịch VSV của 2 chủng theo tỷ lệ 1:1, 1:2, 2:1 (ml/ml). Hỗn hợp dịch VSV được phối trộn vào chất mang (bã thải trồng nấm) với tỷ lệ 10% (ml/g). Tỷ lệ hỗn hợp dịch phù hợp khi mật độ tế bào VSV là cao nhất và hoạt tính sinh học của VSV ổn định trong các thời điểm kiểm tra 0 giờ, 7 ngày, 15 ngày, 1 tháng.
c. Xác định tỷ lệ phối trộn hỗn hợp dịch sinh khối của các chủng VSV: chất mang
* Tiến hành:
Sau khi thu nhận được kết quả từ hai phương pháp trên, phối trộn hỗn hợp dịch sinh khối phù hợp vào chất mang theo tỷ lệ 5/100; 10/100, 15/100 và 20/100 (ml/g). Tỷ lệ phối trộn phù hợp khi mật độ tế bào VSV là cao nhất và hoạt tính sinh học của VSV ổn định trong các thời điểm kiểm tra 0 giờ và sau 30 ngày.
- Đánh giá chế phẩm vi sinh
* Tiến hành:
– Chuẩn bị bã thải nấm và bã trái cây, bổ sung chế phẩm vi sinh đã bảo quản sau 30 ngày (thay thế men muối và men đường). Song song với đó, chúng tôi chuẩn bị bã thải nấm ủ theo phương pháp Takakura.
– Hai loại nguyên liệu này, được trộn với phân bò theo tỉ lệ 1:1 dùng làm thức ăn để nuôi trùn quế.
– Chuẩn bị các hộp nhựa nhỏ, mỗi hộp có đường kính 5cm, cao 8cm, miệng hộp đậy kín bằng vải. Thêm 10g thức ăn cho vào hộp, bổ sung nước đến độ ẩm 70 – 80%. Các nghiệm thức được lặp lại 6 lần
– Mỗi nghiệm thức 6 hộp, mỗi hộp cho một con trùn non có khối lượng ban đầu tương đương nhau từ 0.01 – 0.05g. Sau 2 tuần, lấy ra rửa sạch với nước cất, thấm khô bằng vải rồi cân và ghi lại khối lượng.
Mỗi thí nghiệm được lặp lại 3 lần. Số liệu được xử lý bằng phần mềm Microsoft Office Excel 2010 (với độ tin cậy trên 95%).
CHƯƠNG 3
KẾT QUẢ VÀ THẢO LUẬN
3.1. Kết quả ủ bã thải nấm bằng phương pháp Takakura
Sau khi thực hiện thí nghiệm như phần 2.1, chúng tôi thu được kết quả như hình 3.1
| Hình 3.1. Sự thay đổi nhiệt độ khi ủ bả thải mùn cưa bằng phương pháp Takakura |
Từ kết quả hình 3.1. nhận thấy nhiệt độ đống ủ bắt đầu tăng sau 12h và đạt tối đa 60⁰C sau 24h ủ; duy trì ở khoảng 58-60⁰C đến 40h; sau đó thì nhiệt độ giảm dần. Điều này cho thấy quá trình lên men đã xảy ra, có sự hoạt động của VSV sinh cellulase, do đó có thể sử dụng nguồn bã thải mùn cưa sau qúa trình ủ này để làm nguồn phân lập VSV phân huỷ cellulose và có thể ưa nhiệt đến 60⁰C.
3.2. Kết quả phân lập và tuyển chọn giống VSV phân hủy cellulose cao
Kết quả có 3 chủng được lựa chọn là BU01, BU06 và BU09. Trong 3 chủng này, có thể nhận thấy chủng BU01 có đường kính vòng phân giải lớn nhất có thể có hoạt tính cellulase mạnh nhất. Chủng BU06 có đường kính phân giải nhỏ hơn chủng BU01 và BU09 có đường kính vòng phân giải nhỏ nhất trong 3 chủng. Cả 3 chủng này đều được sử dụng cho khảo sát tiếp theo.
3.3. Kết quả tuyển chọn chủng VSV có khả năng phân giải cellulose và chiụ nhiệt
Ba chủng VSV có sinh enzymee cellulase đã chọn ở trên được nuôi cấy các mức nhiệt độ 50⁰C, 55⁰C và 60⁰C trên môi trường chỉ có một nguồn cacbon duy nhất là CMC, để thăm dò khả năng ưa nhiệt của các chủng này. Kết quả có hai chủng BU01 và BU06 mọc được khuẩn lạc ở cả ba mức nhiệt độ này.
3.4. Kết quả tính đối kháng của 2 chủng VSV được chọn
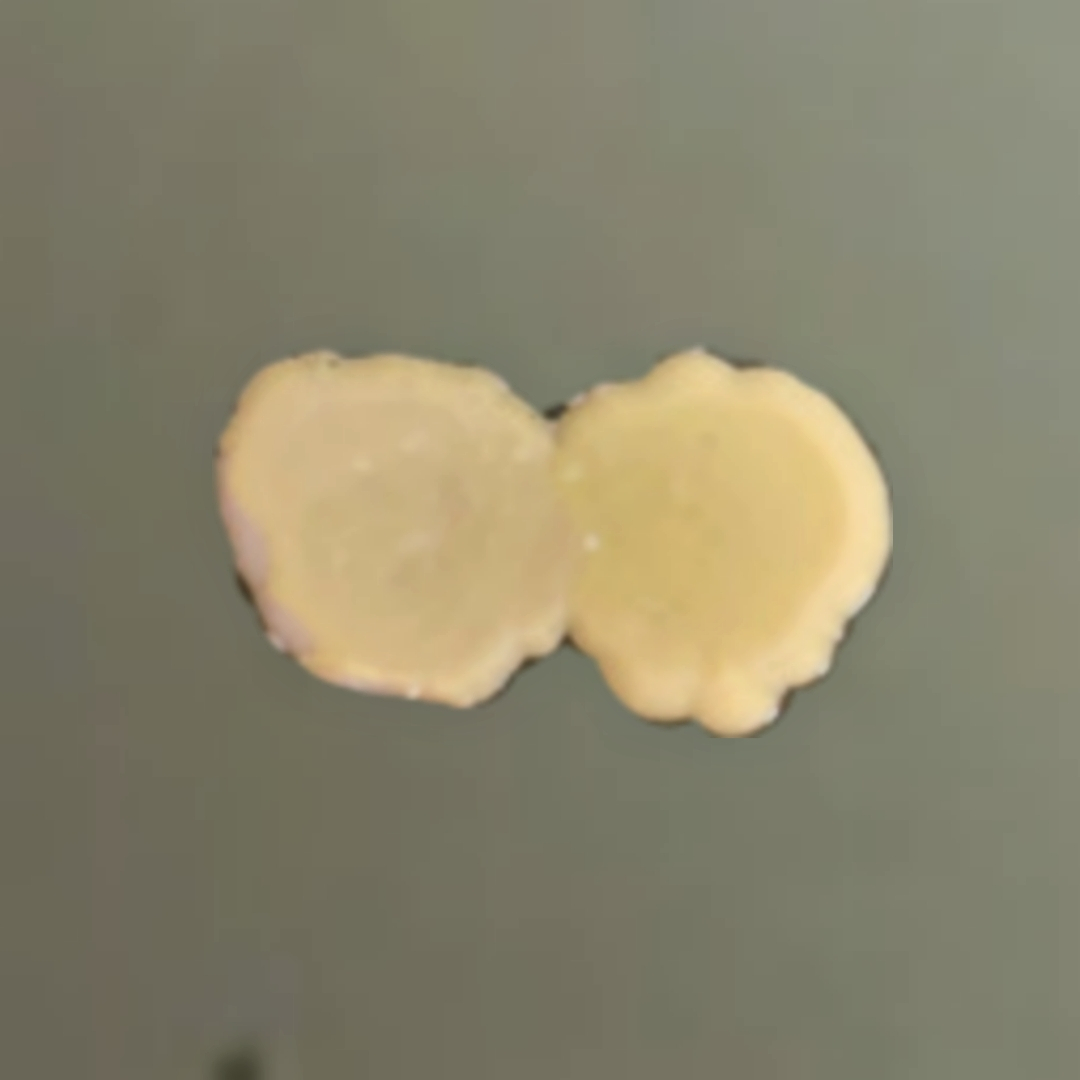 | Nghiên cứu sản xuất chế phẩm vi sinh để xử lý bã thải mùn cưa sau trồng nấm làm thức ăn nuôi trùn quế |
Sau quá trình nuôi cấy trên môi trường LB, chúng tôi nhận thấy sau 72h nuôi cấy, 2 chủng BU01 và BU06 phát triển tốt, khuẩn lạc lớn dần và tiếp xúc nhau, không xuất hiện vòng vô khuẩn. Điều này chứng tỏ, 2 chủng BU01 và BU06 có thể chung sống với nhau và không có hiện tượng đối kháng. Đây là một kết quả quan trọng cho phép phối trộn 2 chủng trong cùng 1 chế phẩm.
3.5. Kết quả định danh 2 chủng VSV được chọn
Chúng tôi tiến hành gửi mẫu định danh VSV sử dụng RNA16S. Thí nghiệm được thực hiện tại PTN của Trung tâm Xét nghiệm Kỹ thuật cao KTest và kết quả ghi nhận chủng BU01 có khả năng cao là Mycolicibacterium smegmatis.
3.5.2. Đinh danh BU06
Chủng BU06 cũng tiến hành gửi mẫu đi định danh RNA 16S cùng với BU01. Kết quả ghi nhận chủng BU06 có khả năng cao là Bacillus smithii.
3.6. Kết quả khảo sát các điều kiện nhân sinh khối của chủng VSV được chọn
Chủng BU01
Chủng BU01 đạt được lượng sinh khối tối ưu khi được nuôi cấy trong môi trường SX1, pH= 7,5 ở nhiệt độ 30⁰C trong 60 giờ.
Chủng BU06
Chủng BU06 đạt được lượng sinh khối tối ưu khi được nuôi cấy trong môi trường SX1, pH= 5,5 ở nhiệt độ 40⁰C trong 16 giờ.
3.7. Kết quả khảo sát các điều kiện tạo chế phẩm vi sinh
3.7.1. Chất mang
Hai chủng BU01 và BU06 sau khi nuôi cấy trên môi trường nhân giống sản xuất trong điều kiện tốt nhất ở phần 3.6 và đạt mật độ tế bào > 108CFU/ml được phối trộn với 3 loại chất mang trên theo theo tỷ lệ dịch VSV: chất mang là 1:10 (ml/g). Kết quả kiểm tra khả năng tồn tại của các chủng VSV sau 30 ngày bảo quản được trình bày trong bảng 3.6
Bảng 3.1. Ảnh hưởng của tỷ lệ dịch sinh khối đến khả năng tồn tại của VSV trên chất mang
| Chất mang | Mật độ tế bào CFU/ml | |||
|---|---|---|---|---|
| BU01 | BU06 | |||
| 0 giờ | 30 ngày | 0 giờ | 30 ngày | |
| Cao lanh | 21,9 x 109±2,83 | 3,38×107±1,41 | 16,6×109±3,54 | 2,39×107±4,24 |
| Cám gạo | 21,9 x 109±2,83 | 4,08×108±2,83 | 16,6×109±3,54 | 3,10×108±2,83 |
| Bã trồng nấm | 21,9 x 109±2,83 | 12,6×109±4,24 | 16,6×109±3,54 | 6,55×109±4,95 |
Sau thời gian bảo quản 30 ngày, mật độ tế bào của 2 chủng BU01 và BU06 đều giảm trên nền chất mang là cám gạo và bã thải nấm; nhưng mật độ tế bào trên 108 CFU/ml nên vẫn đạt tiêu chuẩn chế phẩm vi sinh theo TCVN 6168-2002. Do đó, cả hai loại chất mang này đều có thể sử dụng để phối trộn; tuy nhiên xét về hiệu quả kinh tế thì chúng tôi chọn bã thải nấm làm chất mang phù hợp nhất cho nghiên cứu tiếp theo.
- Tỷ lệ các chủng VSV
Kết quả kiểm tra mật độ tế bào VSV trên chất mang được trình bày trong bảng 3.7
Bảng 3.2. Ảnh hưởng của tỷ lệ dịch sinh khối đến khả năng tồn tại của VSV
| Ký hiệu chủng | Thời gian | Mật độ tế bào CFU/ml | ||
|---|---|---|---|---|
| 1:1 | 1:2 | 2:1 | ||
| BU01 | 0 giờ | 2,3×109±3,54 | 2,1×109±2,83 | 4,2×109±5,66 |
| 7 ngày | 2,2×109±2,12 | 1,8×108±3,54 | 4,2×109±7,07 | |
| 15 ngày | 2,2×109±4,24 | 1,5×108±4,95 | 6,3×109±4,95 | |
| 30 ngày | 2,2×109±1,41 | 1,2×108±4,95 | 7,4×109±4,24 | |
| BU06 | 0 giờ | 1,8×109±2,12 | 3,5×109±5,67 | 1,6×109±3,53 |
| 7 ngày | 1,8×109±4,95 | 3,9×109±4,24 | 1,6×109±7,78 | |
| 15 ngày | 1,7×109±2,83 | 4,2×109±4,24 | 1,3×109±4,95 | |
| 30 ngày | 1,6×109±1,41 | 4,7×108±6,36 | 1,1×109±3,54 | |
Tỷ lệ dịch sinh khối VSV 1:1 là phù hợp để sản xuất chế phẩm VSV xử lý bã thải trồng nấm làm thức ăn nuôi trùn quế.
- Tỷ lệ phối trộn hỗn hợp dịch sinh khối các chủng VSV với chất mang
Bảng 3.3. Ảnh hưởng của tỷ lệ dịch sinh khối đến khả năng tồn tại của VSV trên chất mang là bã thải trồng nấm
| Ký hiệu mẫu | Thời điểm kiểm tra | Mật độ VSV CFU/g | |||
| 5/100 | 10/100 | 15/100 | 20/100 | ||
| BU01 | 0 giờ | 4,6×107±3,54 | 2,3×109±2,83 | 3,2×108±4,24 | 4,2×108±4,24 |
| 30 ngày | 3,8×107±7,78 | 4,4×109±4,24 | 2,9×108±4,24 | 3,8×108±5,66 | |
| BU06 | 0 giờ | 3,7×107±2,83 | 1,8×109±2,83 | 2,5×108±2,83 | 3,6×108±7,07 |
| 30 ngày | 2,3×107±3,54 | 2,9×109±2,83 | 2,1×108±1,41 | 3,3×108±5,66 | |
Tỷ lệ phối trộn dịch sinh khối VSV/bã thải nấm là 10/100, 15/100, 20/100 thì mật độ VSV sau 30 ngày bảo quản duy trì mật độ >108 CFU/g. Kết quả nghiên cứu cho thấy tỷ lệ phối trộn dịch sinh khối VSV/bã thải nấm là 10/100 là phù hợp để sản xuất chế phẩm.
Với thí nghiệm đã được thiết kế, so sánh giữa mẫu thức ăn có sử dụng chế phẩm vi sinh và mẫu thức ăn ủ bằng phương pháp Takakura; sau 2 tuần nuôi trùn quế; chúng tôi nhận thấy có sự tương đương ở cả hai mẫu; trùn quế vẫn ăn tốt thức ăn được xử lý với chế phẩm vi sinh và sinh khối trùn quế đo được sau 2 tuần nuôi tăng khoảng 30% so với sinh khối ban đầu (bảng 3.9). Điều này cho thấy có thể sử dụng chế phẩm vi sinh với tác dụng tương tự như khi ủ bằng phương pháp Takakura.
Bảng 3.9. Sinh khối trùn quế khi nuôi với các nguồn thức ăn khác nhau
| Nghiệm thức | Khối lượng trùn ban đầu (g) | Khối lượng trùn sau 2 tuần (g) |
| Bã mùn cưa ủ bằng Takakura: phân bò (1:1) | 15 0,1 | 19,8 0,2 |
| Bã mùn cưa ủ bằng chế phẩm vi sinh: phân bò (1:1) | 15 0,1 | 20,1 0,3 |
CHƯƠNG 4
KẾT LUẬN
Từ các kết quả nghiên cứu đã thu được, chúng tôi rút ra một số kết luận như sau:
– Đã tuyển chọn được 2 loài vi khuẩn có khả năng phân huỷ cellulose cao và ưa nhiệt từ nguồn bã thải mùn cưa sau trồng nấm khi ủ bằng phương pháp Takakura. Kết quả định danh xác định đây là 2 chủng Mycolicibacterium smegmatis (BU01) và Bacillus smithii (BU06). Hai loài lựa chọn đều có hoạt tính sinh học cao, có khả năng ưa nhiệt độ cao, an toàn với con người, vật nuôi và có khả năng tổ hợp cùng nhau tạo chế phẩm VSV bổ sung vào đống ủ bã thải trồng nấm.
– Đã xác định được các điều kiện tối ưu nhân sinh khối chủng BU01 (môi trường SX1, pH 7.5, nhiệt độ 300C, trong 60h); chủng BU06 (môi trường SX1, pH 5.5, nhiệt độ 400C, trong 16h). Sau khi nhân giống sản xuất riêng lẽ từng chủng, tiến hành phối trộn dung dịch sinh khối theo tỉ lệ 1:1; trộn với chất mang bã thải nấm theo tỉ lệ 10% tạo được chế phẩm VSV đạt yêu cầu về mật độ tế bào VSV theo TCVN 6168-2002 (mật độ tế bào VSV đạt >108 CFU/g) và đảm bảo mật độ VSV >108 CFU/g sau 30 ngày bảo quản.
– Chế phẩm sau 30 ngày bảo quản đem ủ cùng bã thải nấm và bã trái cây (thay thế men muối men đường) sau đó trộn với phân bò theo tỉ lệ 1:1 đem làm thức ăn nuôi trùn quế; cho hiệu quả tương đương với nguồn thức ăn ủ bằng phương pháp Takakura.
E:\DỮ LIỆU COP CỦA CHỊ YẾN\DAI HOC DA NANG\CONG NGHE SINH HỌC\CONG NGHE SINH HOC





